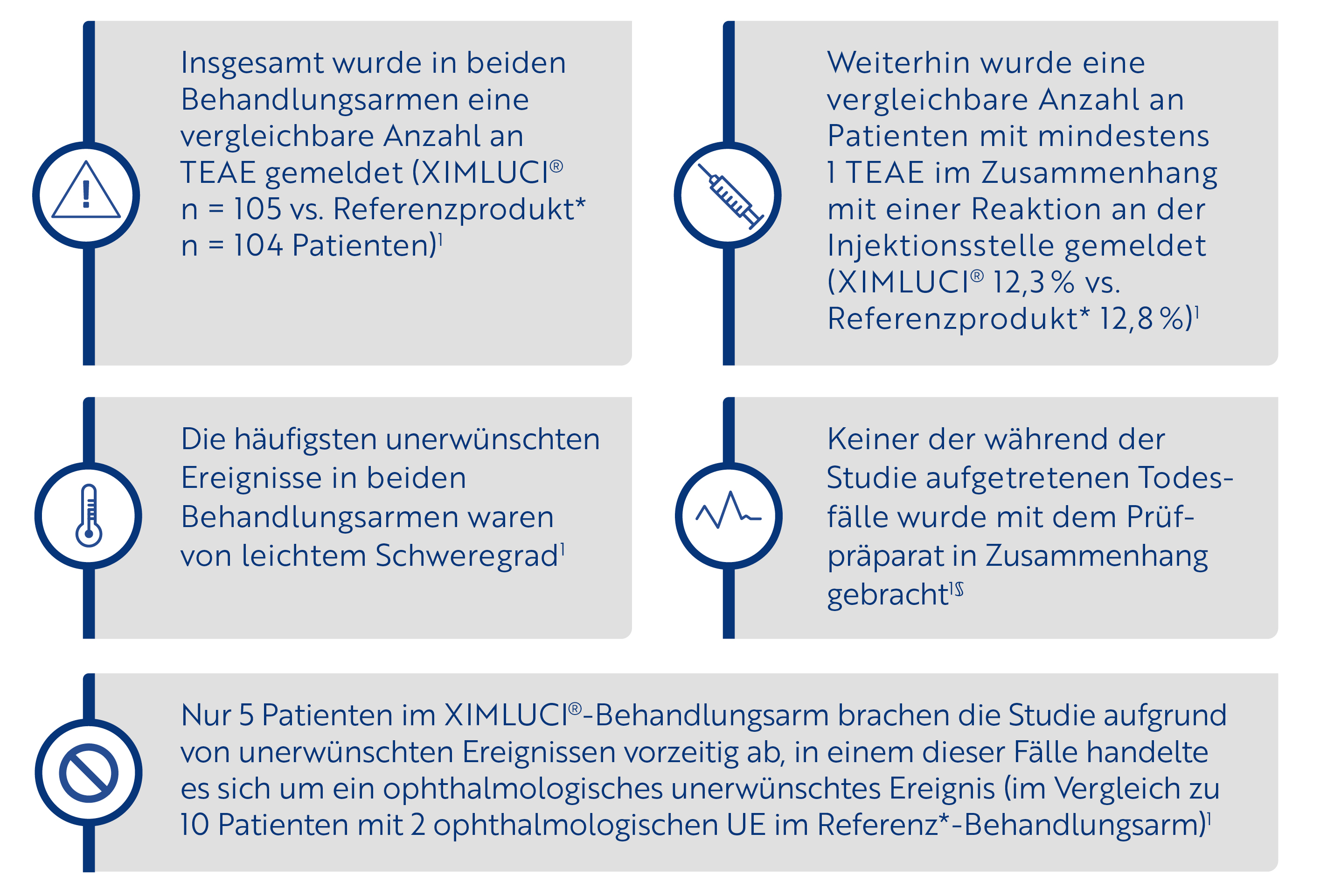
XIMLUCI® Sicherheits- und Immunogenitätsprofil
XIMLUCI® zeigte durchgängig ein vergleichbares Sicherheitsprofil mit dem Referenzprodukt*.
Im Rahmen der XPLORE-Studie ermitteltes Sicherheitsprofil1†‡
Übersicht Patienten mit ≥ 1 ophthalmologischen TEAE (Sicherheitsdatensatz)†‡
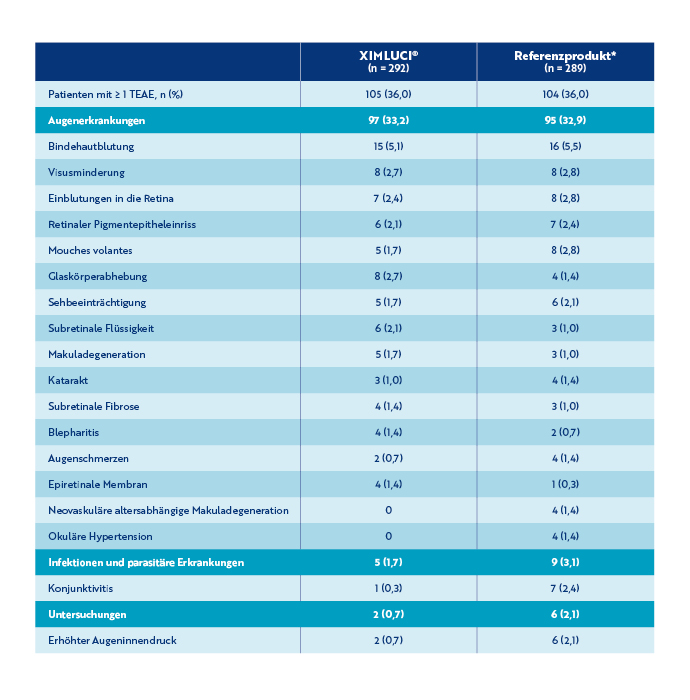 Der Anteil der Patienten mit ≥ 1 ophthalmologischen TEAE im Studienauge war in beiden Behandlungsarmen vergleichbar.
Der Anteil der Patienten mit ≥ 1 ophthalmologischen TEAE im Studienauge war in beiden Behandlungsarmen vergleichbar.
Anteil der Patienten mit einer Verschlechterung der BCVA um < 15 Buchstaben oder einer Verbesserung der BCVA um ≥ 15 Buchstaben im Vergleich zum Ausgangswert
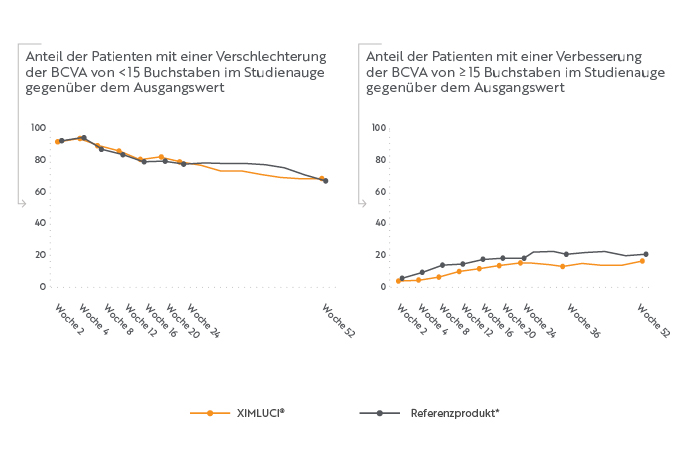
Der Anteil der Patienten mit einer Verschlechterung der BCVA um < 15 Buchstaben war in beiden Behandlungsarmen hoch, was darauf hindeutete, dass beide Gruppen über den Zeitraum von 52 Wochen ein gutes Ansprechen auf die Behandlung zeigten1. Im Referenzarm zeigte sich ein minimal größerer Anteil an Patienten mit einer Verbesserung um ≥ 15 Buchstaben als im XIMLUCI®-Arm, was dem beobachteten Trend im primären Endpunkt entspricht.1
Bei den Ergebnissen zur Immunogenität wurden zwischen XIMLUCI® und dem Referenzprodukt* keine nennenswerten Unterschiede verzeichnet. Die Inzidenz sowohl neutralisierender ADA als auch positiver ADA war in beiden Behandlungsgruppen zu allen ausgewerteten Zeitpunkten vergleichbar.1
*LUCENTIS®, †Sicherheitsanalysen wurden bei allen Patienten durchgeführt, die mindestens eine Dosis des Prüfpräparats erhalten haben (Safety Set), ‡Die durchschnittliche Behandlungsdauer war in beiden Behandlungsarmen vergleichbar (311,9 Tage mit XIMLUCI®; 312,3 Tage mit dem Referenzprodukt*), §Während der Studie wurden 8 Todesfälle im XIMLUCI®-Arm verzeichnet, wovon nach Einschätzung des Prüfarztes keiner auf das Prüfpräparat zurückzuführen war (Herz-Kreislauf-Stillstand, akutes Nierenversagen, Herzstillstand, COVID-19-Infektion, Herzinsuffizienz, Alter und unbekannte Ursache). Während der Studie wurden 3 Todesfälle im Referenz-Arm verzeichnet, wovon nach Einschätzung des Prüfarztes keiner auf das Prüfpräparat zurückzuführen war (COVID-19-Infektion, Pankreatitis).
ADA: Anti-Drug-Antikörper, TEAE: behandlungsbedingtes unerwünschtes Ereignis, UE: unerwünschtes Ereignis
Referenzen:
- XIMLUCI®: EPAR – Public Assessment Report. Abrufbar unter: https://www.ema.europa.eu/en/documents/assessment-report/ximluci-epar-public-assessment-report_en.pdf. Abgerufen im Februar 2023.


