Was ist ein Biosimilar?
Biosimilars sind dem Referenzarzneimittel sehr ähnlich und zeigen eine vergleichbare Wirksamkeit und ein vergleichbares Sicherheitsprofil1
Was sind Biosimilars:
Ein Biosimilar ist ein biologisches Arzneimittel, das einem anderen bereits zugelassenen biologischen Arzneimittel (dem "Referenzarzneimittel“) sehr ähnlich ist. Biosimilars werden nach denselben Standards für pharmazeutische Qualität, Sicherheitsparameter und Wirksamkeit zugelassen, die für alle biologischen Arzneimittel gelten.2
Merkmale von Biosimilars:1
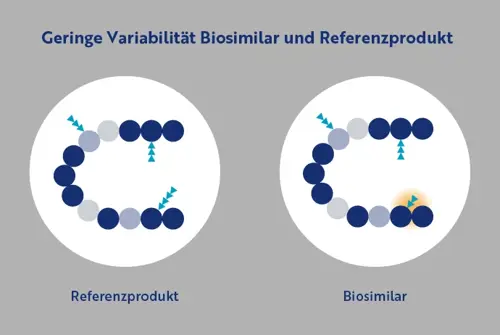
- Referenzarzneimittel und Biosimilar haben dieselbe Aminosäuresequenz und Proteinfaltung und somit die gleiche biologische Aktivität.
- Biosimilars müssen dem Referenzarzneimittel sehr ähnliche physikalische, chemische und biologische Eigenschaften aufweisen.
- Es darf keine klinisch bedeutsamen Unterschiede im Vergleich zum Referenzprodukt geben.
- Biologika werden in lebenden Organismen hergestellt; das führt dazu, dass sie eine natürliche Variabilität aufweisen. Diese Variabilität muss innerhalb strenger Grenzen liegen, die von den Behörden vorgegeben werden.
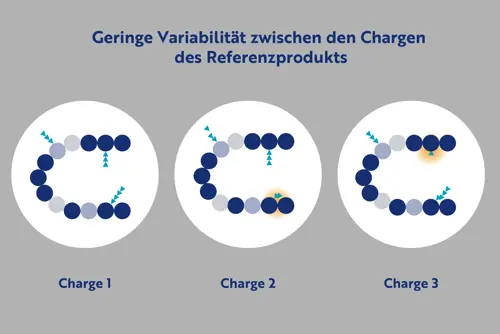
- Diese geringfügigen Abweichungen werden auch als Mikroheterogenität bezeichnet (dargestellt durch die orangefarbene Schattierung) und entstehen durch Modifikationen wie z. B. unterschiedliche Glykosylierung (blaue Dreiecke).
- Die Unterschiede zwischen dem Referenzarzneimittel und dem Biosimilar sind vergleichbar zu denen zwischen verschiedenen Chargen des Referenzarzneimittels.
Modifiziert nach: Europäische Arzneimittel-Agentur (EMA). Biosimilars in der EU. Leitfaden für medizinische Fachkräfte.1
- Klinische Studien zur Stützung der Zulassung eines Biosimilars müssen bestätigen, dass etwaige Unterschiede das Sicherheitsprofil und die Wirksamkeit nicht beeinträchtigen.1
- Die Sicherheits- und Wirksamkeitsdaten einer sensitiven Indikation können auf andere Indikationen extrapoliert werden, für die das Referenzprodukt bereits zugelassen ist.1
- Biosimilars werden nach einer gründlichen Prüfung der Gesamtheit aller Daten aus allen Phasen der Entwicklung von der EMA zugelassen: Damit hat das Biosimilar eine hohe Ähnlichkeit zum Referenzprodukt bezüglich:1

Struktur
biologischer Aktivität
Wirksamkeit

Sicherheitsprofil
Immunogenitätsprofil
Biosimilars sind keine Generika eines biologischen Arzneimittels
Aufgrund der natürlichen Variabilität und des komplexen Herstellungsprozesses sind für die behördliche Zulassung von Biosimilars mehr Studien nötig als für Generika. Damit soll sichergestellt werden, dass geringfügige Unterschiede keine Auswirkung auf die Sicherheitsparameter oder die Wirksamkeit haben.1
Tabelle: Vergleich der Entwicklung und Eigenschaften von Generika und Biosimilars
|
Generika |
Biosimilars |
|
Werden gewöhnlich durch chemische Synthese hergestellt |
Werden durch biochemische Synthese in lebenden Zellen hergestellt |
|
Es ist im Allgemeinen möglich, das exakt gleiche Molekül zu erhalten |
Es ist möglich, das Molekül mit einem hohen Grad an Ähnlichkeit nachzubilden |
|
Meist kleinere Moleküle, die leichter zu charakterisieren sind |
Im Allgemeinen größere, strukturell komplexere Moleküle, die für ihre Charakterisierung verschiedene Technologien benötigen |
|
Vollständige Datenanforderungen bezüglich der pharmazeutischen Qualität |
Vollständige Datenanforderungen bezüglich der pharmazeutischen Qualität und zusätzliche Qualitätsuntersuchungen zum Vergleich der Struktur und biologischen Aktivität des Biosimilars mit dem Referenzprodukt |
|
Entwicklung basierend auf dem Nachweis der Bioäquivalenz |
Entwicklung basierend auf dem Nachweis der Äquivalenz mithilfe von Vergleichbarkeitsstudien (umfassender direkter Vergleich des Biosimilars mit dem Referenzprodukt) |
|
Die klinischen Datenanforderungen bestehen hauptsächlich aus Untersuchungen zur pharmakokinetischen Bioäquivalenz |
Zusätzlich zu vergleichenden pharmakokinetischen und pharmakodynamischen Untersuchungen können Daten über die Sicherheitsparameter und die Wirksamkeit erforderlich sein, insbesondere bei komplexeren Biologika |
|
Für alle Indikationen, für die das Referenzprodukt zugelassen ist, kann auf der Grundlage der nachgewiesenen Bioäquivalenz eine Zulassung erteilt werden, ohne dass weitere klinische Daten erforderlich sind |
Wirksamkeit und Sicherheitsprofil müssen für jede Indikation gerechtfertigt werden. Nach dem Nachweis der Äquivalenz ist eine Extrapolation der Daten auf andere Indikationen möglich |
Modifiziert nach: Europäische Arzneimittel-Agentur (EMA). Biosimilars in der EU. Leitfaden für medizinische Fachkräfte.1
Positionierung von Biosimilars
Die Zulassung von Biosimilars in Europa basiert auf einem soliden Rechtsrahmen.1
- Im Jahr 2004 wurde von der EMA ein eigenes Verfahren für die Zulassung von Biosimilars eingeführt.1
- Das erste Biosimilar Omnitrope® (Somatropin) wurde 2006 in Europa zugelassen.1,3
- Die EMA hat weltweit die meisten Biosimilars zugelassen und beträchtliche Erfahrungen in puncto Anwendung und Arzneimittelsicherheit gesammelt.1
- Biosimilars bieten Vorteile für Gesundheitssysteme und erleichtern den Zugang von Patienten zu lebensverändernden Behandlungen in einer Vielzahl von Indikationen.1
Biosimilars sind aufgrund ihrer vergleichbaren Wirksamkeit, Sicherheits- und Immunogenitätsprofile mit ihrem Referenzprodukt austauschbar:4
- Die Austauschbarkeit von Biosimilars bezieht sich auf die Möglichkeit, ein Arzneimittel gegen ein anderes Arzneimittel auszutauschen, von dem erwartet wird, dass es die gleiche klinische Wirkung hat.
- Im September 2022 wurde in einer gemeinsamen Stellungnahme der EMA und des HMA bestätigt, dass ein Biosimilar nach seiner Zulassung austauschbar ist und anstelle des Referenzprodukts verwendet werden kann (oder umgekehrt) bzw. dass ein Biosimilar durch ein anderes Biosimilar desselben Referenzprodukts ersetzt werden kann.
Biosimilars:




STADAPHARM* hat mehr als 20 Jahre Erfahrung mit Biosimilars† mit fünf erfolgreichen Biosimilars auf dem Markt, darunter Adalimumab, Bevacizumab, Teriparatid, Epoetin sowie Pegfilgrastim, und mit einem kontinuierlich wachsenden Portfolio.
Aufbauend auf der Innovation biologischer Arzneimittel stellt STADAPHARM wirtschaftliche Alternativen zu Referenzprodukten zur Verfügung.
* STADAPHARM ist ein 100%iges Tochterunternehmen der STADA Arzneimittel AG.
† STADA gründete die Bioceuticals Arzneimittel AG als Biogenerics Arzneimittel AG im Jahr 2000 und erhielt ihre erste biosimilare Zulassung 2007 für Epoetin zeta.
Referenzen:
- Europäische Arzneimittel-Agentur (EMA). Biosimilars in der EU. Leitfaden für medizinische Fachkräfte. Abrufbar unter: https://www.ema.europa.eu/en/documents/leaflet/biosimilars-eu-information-guide-healthcare-professionals_de.pdf. Letzter Zugriff: Februar 2023.
- Europäische Arzneimittel-Agentur (EMA). Biosimilar medicines: Overview. Verfügbar unter: https://www.ema.europa.eu/en/human-regulatory/overview/biosimilar-medicines-overview. Letzter Zugriff: Februar 2023.
- Generics and biosimilars initiative. Biosimilars approved in Europe. Abrufbar unter: https://www.gabionline.net/biosimilars/general/biosimilars-approved-in-Europe. Letzter Zugriff: Februar 2023.
- Europäische Arzneimittel-Agentur (EMA). Statement on the scientific rationale supporting interchangeability of biosimilar medicines in the EU. Abrufbar unter: https://www.ema.europa.eu/en/news/biosimilar-medicines-can-be-interchanged. Letzter Zugriff: Februar 2023.
- Chopra R, Lopes G. J Glob Oncol. 2017;3(5):596.