Langzeitdaten der Phase-III-Studie: Anhaltende Wirksamkeit und bestätigtes Verträglichkeitsprofil
Die zulassungsrelevante Phase-III-Studie NeflgArd bestand aus zwei Teilen. Die Daten aus Teil A bildeten die Basis für die vorläufige Zulassung von Kinpeygo® zur Behandlung von Patienten mit primärer IgA-Nephropathie (IgAN) und einem Risiko für eine rasche Krankheitsprogression (UPCR ≥ 1,5 g/Gramm).1,2,*
Die Daten aus Teil B bestätigen die Studienergebnisse aus Teil A. Über einen zusätzlichen Follow-up-Zeitraum von 12 Monaten (Teil B), also einem gesamten Nachbeobachtungszeitraum von 15 Monaten, zeigen die Daten eine anhaltende Wirksamkeit der 9-monatigen Behandlung mit Kinpeygo® bei einem weiterhin guten Verträglichkeitsprofil nach insgesamt 2 Jahren.2,3 Diese Daten bilden die Grundlage für die volle Zulassung von Kinpeygo®.1-3
Übersicht über Teil B der Studie3
Teil B der Phase-III-Studie stellte eine Nachbeobachtungsphase von 12 Monaten dar, die sich an Teil A der Studie bestehend aus einer 9-monatigen Behandlung mit Kinpeygo® sowie einer Nachbeobachtungsphase von 3 Monaten anschloss. Im gesamten Studienzeitraum von 24 Monaten wurden die Patienten also für 9 Monate mit Kinpeygo® behandelt und insgesamt für 15 Monate beobachtet.3 Sie diente der Bestätigung der Langzeitschutzwirkung der Niere durch einen von der EMA vorgeschlagenen eGFR-basierten Endpunkt über 2 Jahre und der Validierung der Proteinurie als Surrogatparameter für die Progression zur terminalen Niereninsuffizienz (ESRD). Die Ein- und Ausschlusskriterien sowie das Studiendesign von NeflgArd finden Sie hier.
Teil B: Primäre und sekundäre Endpunkte3
Primärer Endpunkt
- zeitgewichteter Durchschnitt der eGFR über 2 Jahre**
Wichtige sekundäre Endpunkte
- mittlere UPCR und UACR im Vergleich zur Baseline über 2 Jahre
- Zeit von der Randomisierung bis zu einer bestätigten 30%igen Verringerung der eGFR oder einem bestätigten Nierenversagen# (kombinierter Endpunkt)
- Anteil der Patienten ohne Mikrohämaturie nach 2 Jahren
- deskriptive statistische Analysen der sicherheitsrelevanten Ergebnisse
Primärer Endpunkt der Phase-III-Studie Teil B war die Veränderung der eGFR über 2 Jahre im Vergleich zur Baseline, die als Anhaltspunkt für die Progression der IgAN galt.3
Demographische Daten bei Studienbeginn3

CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; eGFR: estimated glomerular filtration rate (geschätzte glomeruläre Filtrationsrate); UACR: urine albumin-to-creatinine ratio (Albumin/Kreatinin-Ratio im Urin); UPCR: urine protein-to-creatinine ratio (Protein/Kreatinin-Ratio im Urin). Datenangabe in % oder Median. °Berechnet vom Zentrallabor anhand der CKD-EPI-Formel.4
Mod. nach: Lafayette et al. (2023).3
Nutzung von RAS-Inhibitoren bei Studienbeginn3
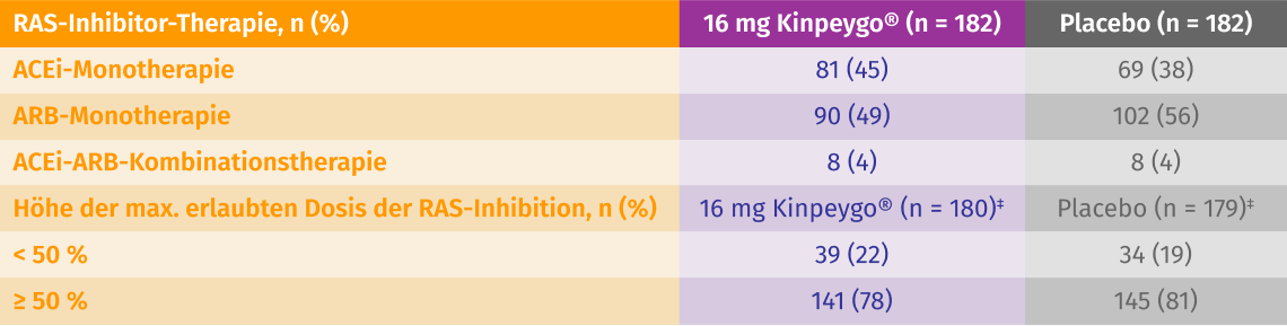
RAS: Renin-Angiotensin-System; ACEi: angiotensin-converting enzyme inhibitor (Angiotensinkonversionsenzym-Inhibitor); ARB: angiotensin receptor blocker (Angiotensin-Rezeptor-Blocker). ‡ n ist die Anzahl der Patienten, für die die Daten zur maximal zulässigen Dosis vorlagen; der Grad der RAS-Inhibition fehlt für Patienten, für deren Therapie keine maximal zulässige Dosis verfügbar war. Bei Patienten, die sowohl einen ACEi als auch einen ARB einnahmen, wurde die Summe der prozentualen Anteile der zulässigen Höchstdosis für beide zusammengefasst.
Mod. nach: Lafayette et al. (2023).3
Anhaltende Wirksamkeit
Kinpeygo® (16 mg einmal täglich morgens, mind. 1h vor einer Mahlzeit, 9-monatige Behandlung) erwies über die gesamte Studienzeit eine anhaltende Wirksamkeit sowohl in Bezug auf den primären Endpunkt als auch auf die sekundären Endpunkte.2,3
Primärer Endpunkt
Kinpeygo® zeigte im Vergleich zu Placebo einen signifikanten Behandlungsvorteil im zeitgewichteten Durchschnitt der eGFR über 2 Jahre (Unterschied von 5,05 ml/min/1,73 m2, p < 0,0001). Nach 9 Monaten Behandlung wies die Kinpeygo® -Gruppe eine mittlere Veränderung der eGFR von 0,66 ml/min/1,73 m2 auf, verglichen mit -4,56 ml/min/1,73 m2 in der Placebo-Gruppe. Der beobachtete Vorteil durch die 9-monatige Behandlung mit Kinpeygo® blieb während der 15-monatigen Beobachtungsphase konstant. Nach 2 Jahren betrug die Veränderung der eGFR gegenüber der Baseline in der Kinpeygo® -Gruppe -6,11 ml/min/1,73 m2 im Vergleich zu -12,00 ml/min/1,73 m2 in der Placebo-Gruppe. Somit zeigte sich bei den mit Kinpeygo® behandelten Patienten über einen Zeitraum von 2 Jahren ein um 50% reduzierter Verlust der Nierenfunktion.3
Veränderung der eGFR gegenüber dem Ausgangswert über 2 Jahre in der Gesamtpopulation3
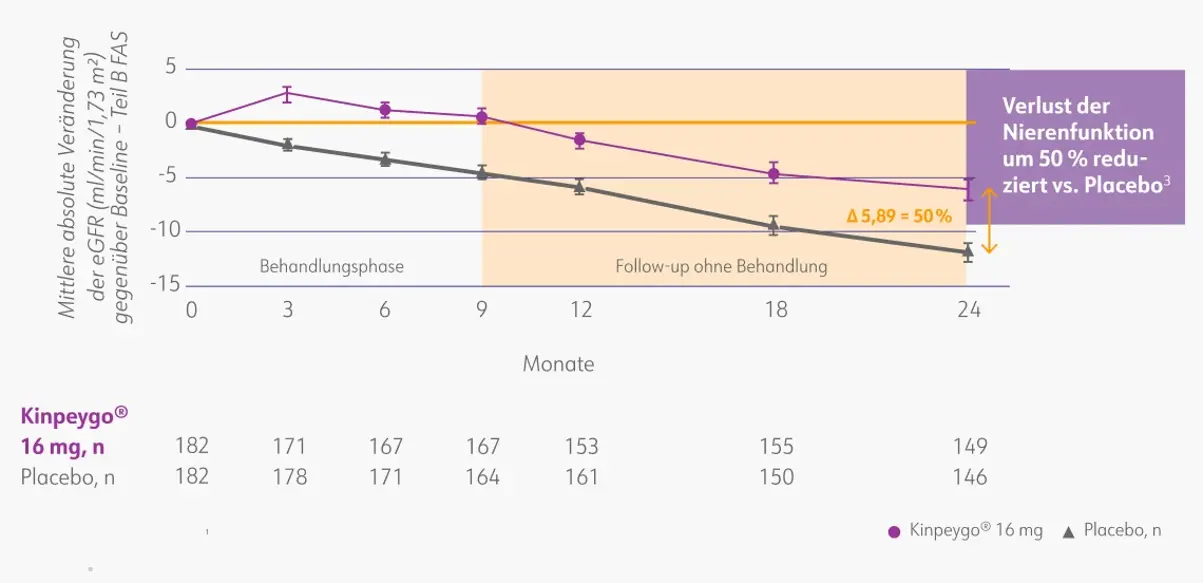
eGFR: estimated glomerular filtration rate (geschätzte glomeruläre Filtrationsrate); FAS: full analysis set (vollständiges Analyse-Set). Mod. nach: Lafayette et al. (2023).3
Der 2-Jahres-Behandlungseffekt auf die eGFR wurde auch in der zulassungsrelevanten Subgruppe, die nur aus Patienten mit ausgeprägter Proteinurie (UPCR ≥ 1,5 g/Gramm) bestand, beobachtet. In dieser Gruppe verlangsamte Kinpeygo® ebenfalls die Progression der IgAN über die Follow-up-Zeit.3
Veränderung der eGFR gegenüber dem Ausgangswert über 2 Jahre in der Subgruppe UPCR ≥ 1,5 g/Gramm3
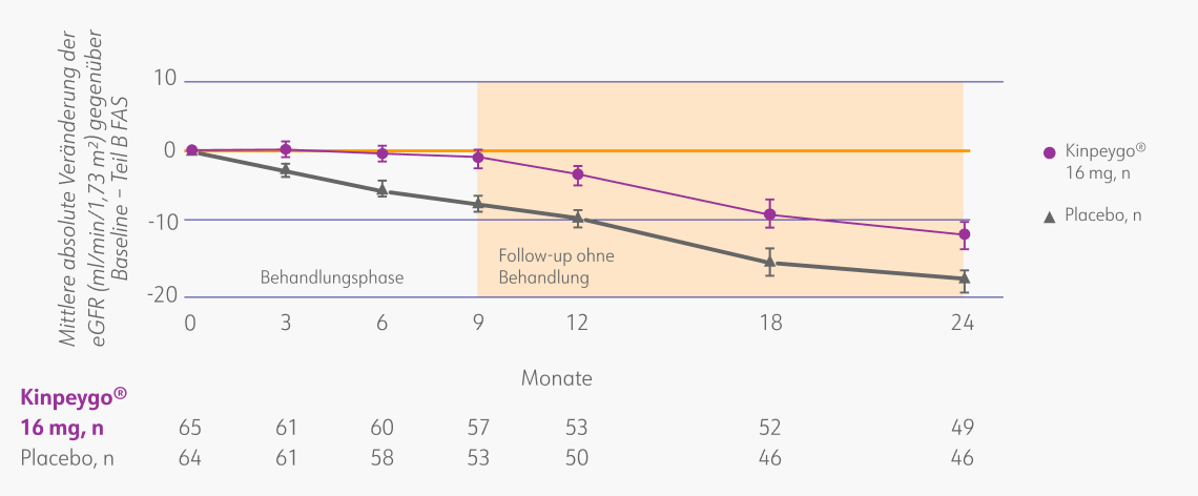
eGFR: estimated glomerular filtration rate (geschätzte glomeruläre Filtrationsrate); FAS: full analysis set (vollständiges Analyse-Set). Mod. nach: Lafayette et al. (2023).3
Sekundäre Endpunkte
Kinpeygo® überzeugte in Teil B der Phase-III-Studie auch in Hinblick auf die wesentlichen sekundären Endpunkte. Die zeitlich gemittelte UPCR-Reduktion betrug 40,3 % in der Kinpeygo®-Gruppe und 1,0 % in der Placebo-Gruppe (p < 0,0001). Die prozentuale Reduktion der UPCR in der Kinpeygo®-Gruppe war nach 2 Jahren sehr ähnlich zu dem Effekt, der am Ende des 9-monatigen Behandlungszeitraums beobachtet wurde und betrug 30 %. Die maximale Wirkung von Kinpeygo® im Vergleich zu Placebo wurde nach 12 Monaten beobachtet, mit einer Reduktion der UPCR um rund 50 %.3
Prozentuale Veränderung der UPCR (g/Gramm) gegenüber dem Ausgangswert über 2 Jahre in der Gesamtpopulation3
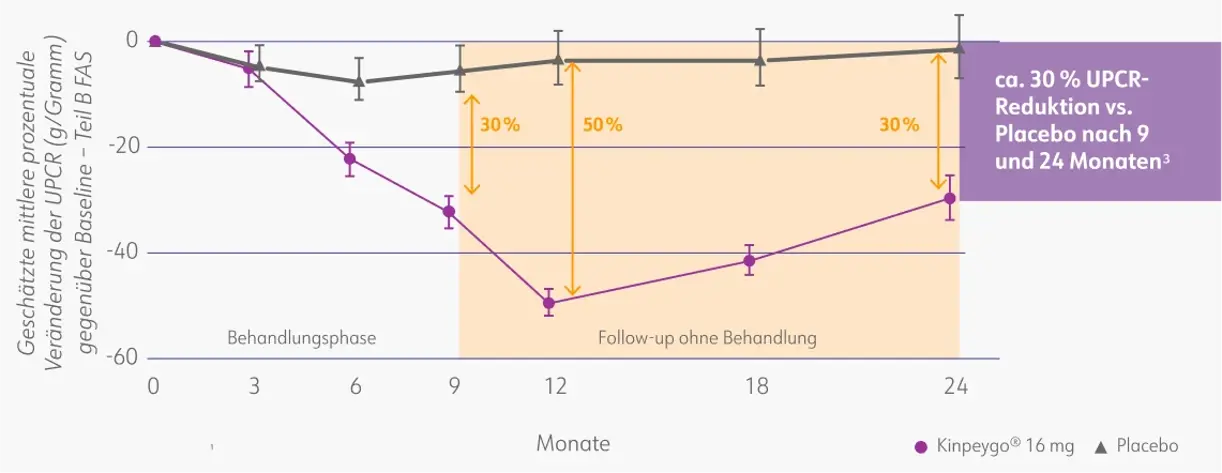
FAS: full analysis set (vollständiges Analyse-Set); UPCR: urine protein-to-creatinine ratio (Protein/Kreatinin-Ratio im Urin). Mod. nach: Lafayette et al. (2023).3
Der Effekt von Kinpeygo® auf die UACR war ähnlich zu den UPCR-Beobachtungen. Die zeitlich gemittelte UACR-Reduktion betrug 48,2 % in der Kinpeygo®-Gruppe und 3,7 % in der Placebo-Gruppe (p < 0,0001).3
Prozentuale zeitlich gemittelte Reduktion der UACR (g/Gramm) gegenüber dem Ausgangswert über 2 Jahre in der Gesamtpopulation3
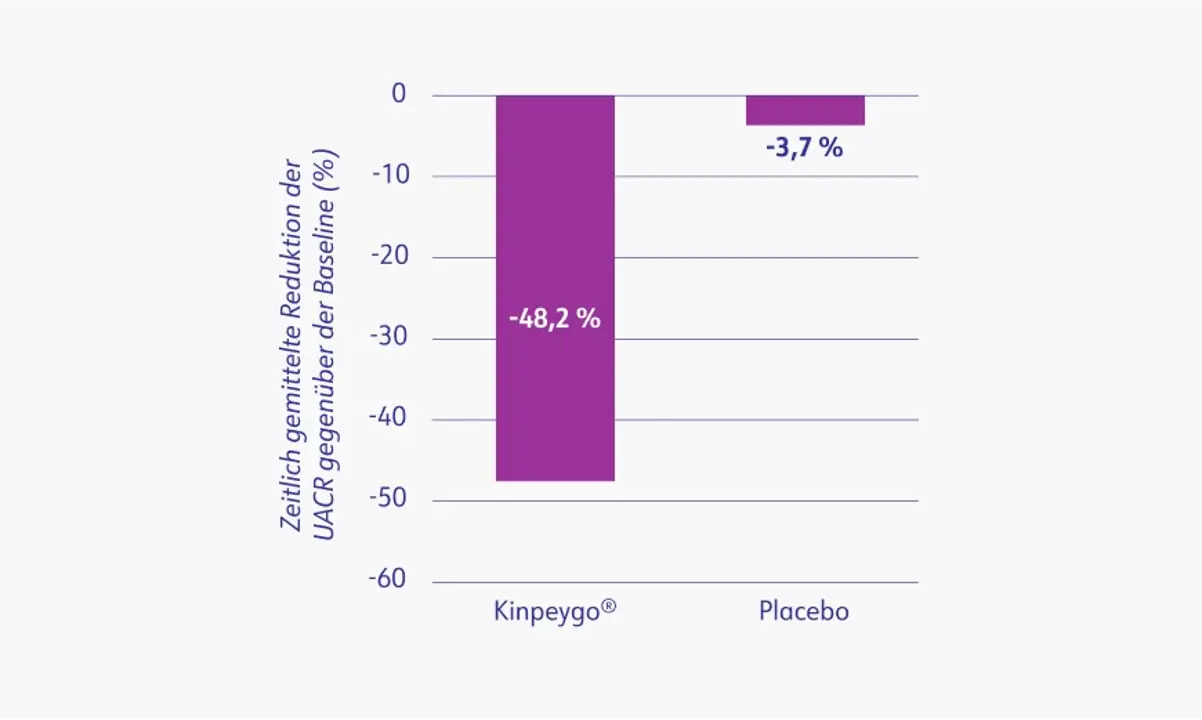
UACR: urine albumine-to-creatinine ratio (Albumin/Kreatinin-Ratio im Urin). Mod. nach: Lafayette et al. (2023).3
Kinpeygo® konnte zudem die Zeit von der Randomisierung bis zu einer bestätigten 30%igen Reduktion der eGFR oder einem Nierenversagen im Vergleich zu Placebo signifikant verzögern (HR: 0,45; p = 0,0014). Insgesamt hatten 12 % der mit Kinpeygo® behandelten Patienten ein bestätigtes Ereignis, während der Anteil in der Placebo-Gruppe 21 % betrug.3
Prozentualer Anteil der Patienten mit einer 30%igen eGFR-Reduktion oder einem Nierenversagen# innerhalb von 2 Jahren3

eGFR: estimated glomerular filtration rate (geschätzte glomeruläre Filtrationsrate). †In Abwesenheit von Notfallmedikation. Mod. nach: Lafayette et al. (2023).3
Auch der Anteil der Patienten, die während der Nachbeobachtungszeit keine Mikrohämaturie aufwiesen, war in der Kinpeygo®-Gruppe deutlich höher als in der Placebo-Gruppe (59 % gegenüber 39 %; OR: 2,5; p = 0,0001).3
Prozentualer Anteil der Patienten ohne Mikrohämaturie unter Kinpeygo® über 2 Jahre im Vergleich zur Baseline3

Mod. nach: Lafayette et al. (2023).3
Verträglichkeit
Teil B der Phase-III-Studie bestätigte über einen Zeitraum von 2 Jahren das allgemein gute Verträglichkeitsprofil von Kinpeygo® aus Teil A.2,3 Die häufigsten behandlungsbedingten unerwünschten Ereignisse waren mild bis moderat und reversibel.3
Die 9-monatige Behandlung mit Kinpeygo® war auch über 2 Jahre im Allgemeinen gut verträglich3

TEAE: treatment-emergent adverse event (behandlungsbedingtes unerwünschtes Ereignis); TESAE: treatment-emergent serious adverse event (behandlungsbedingtes schwerwiegendes unerwünschtes Ereignis). Mod. nach: La Fayette et al. (2023).3
Weitere Ergebnisse zur Langzeit-Sicherheit3
Zusammenfassung der behandlungsbedingten TEAEs in Teil B3
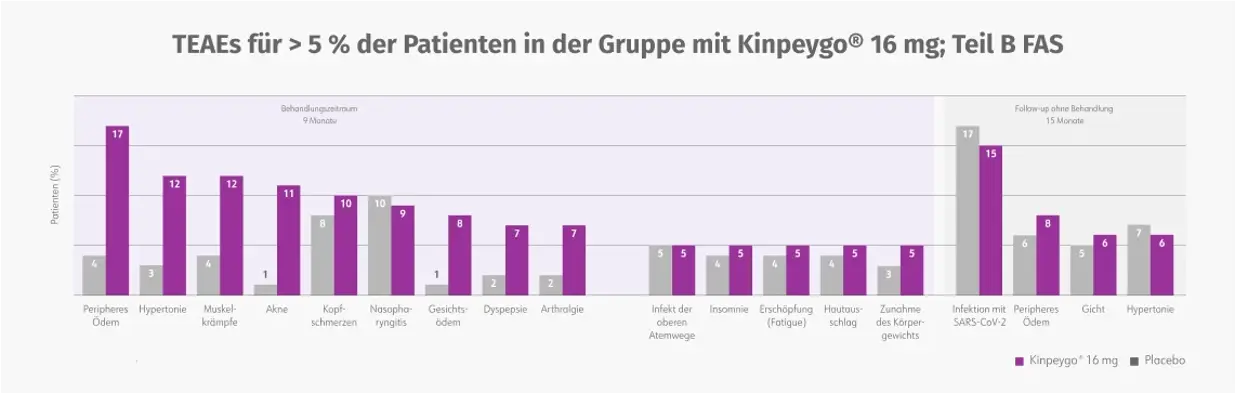
FAS: full analysis set (vollständiges Analyse-Set); TEAE: treatment-emergent adverse event (behandlungsbedingtes unerwünschtes Ereignis).
Mod. nach: Lafayette et al. (2023).3
Langzeiteffekte von Kinpeygo® bei IgA-Nephropathie über 2 Jahre3

Für mehr Informationen besuchen Sie auch unseren Nephrologie-Bereich:


