Phase-III-Studie: Betroffene mit primärer IgAN nach optimal eingestellter RAS-Blockade

Die multizentrische, randomisierte, doppelblinde, Placebo-kontrollierte Phase-III-Studie NefIgArd ist eine zulassungsrelevante Studie, in der die Wirksamkeit und Sicherheit von Kinpeygo® im Vergleich zu Placebo bei erwachsenen Patienten mit durch Biopsie nachgewiesener IgAN unter stabiler RAS-Blockade untersucht wurde.2
Die Studie bestand aus zwei Teilen. Teil A diente als Grundlage für die vorläufige Zulassung von Kinpeygo® und umfasste einen 9-monatigen Behandlungszeitraum, gefolgt von einer dreimonatigen Nachbeobachtungsphase. Teil B besteht aus einer behandlungsfreien 12-monatigen Nachbeobachtungsphase und bildet die Grundlage für die endgültige Zulassung.2,3
Insgesamt 199 Patienten wurden in Teil A analysiert, die zuvor in einem Verhältnis von 1:1 für die 9-monatige Gabe von Kinpeygo® oder Placebo randomisiert wurden.2 Der UPCR-Wert (Protein/Kreatinin-Ratio im Urin) wurde nach 3, 6, 9 und 12 Monaten gemessen2 und dient als hinreichend wahrscheinlicher Surrogatmarker für die Wirkung von Kinpeygo® auf die langfristige Nierenfunktion.4
Einschluss- & Ausschlusskriterien2
Studiendesign – Kinpeygo® vs. Placebo nach optimal eingestellter RAS-Blockade3
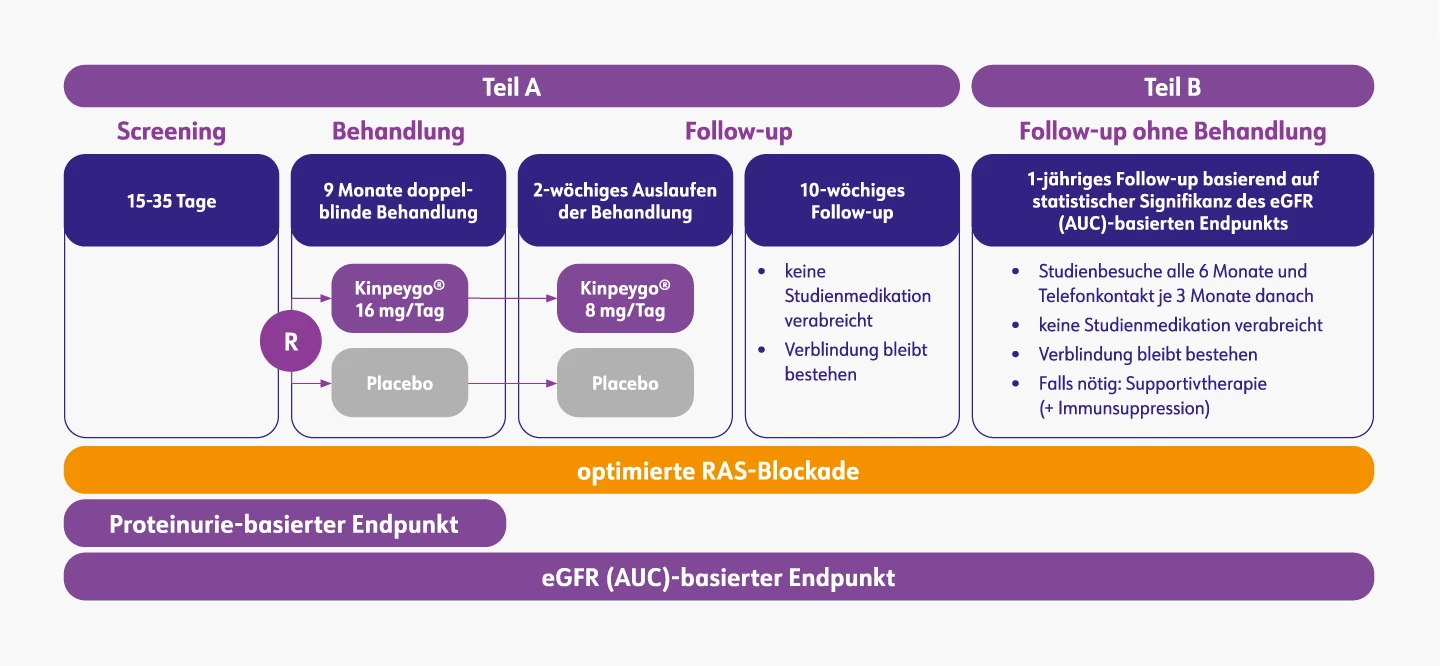 AUC: area under curve (Fläche unter der Kurve); eGFR: estimated glomerular filtration rate (geschätzte glomeruläre Filtrationsrate); RAS: Renin-Angiotensin-System
AUC: area under curve (Fläche unter der Kurve); eGFR: estimated glomerular filtration rate (geschätzte glomeruläre Filtrationsrate); RAS: Renin-Angiotensin-System
Mod. nach: EPAR Kinpeygo® (2022).3
Teil A: Primäre und sekundäre Endpunkte2
Primärer Endpunkt
- 24-Stunden-UPCR nach 9 Monaten im Vergleich zur Baseline (der Behandlungseffekt von Kinpeygo® wurde als prozentuale Veränderung im Vergleich zu Placebo ausgedrückt)
Wichtige sekundäre Endpunkte
- eGFR nach 9 und 12 Monaten im Vergleich zur Baseline
- UACR nach 9 Monaten im Vergleich zur Baseline
- deskriptive statistische Analysen der sicherheitsrelevanten Ergebnisse
Primärer Endpunkt der Phase-III-Studie war die Veränderung der Proteinurie in Form des UPCR-Werts nach 9 Monaten im Vergleich zur Baseline.2 Dies steht in Übereinstimmung mit dem White Paper der Kidney Health Initiative „Proteinuria Reduction as a Surrogate End Point in Trials of IgA Nephropathy“ (dt. Proteinurie-Reduktion als Surrogatendpunkt in Studien zur IgA-Nephropathie), das Anfang 2019 veröffentlicht wurde. Die Arbeitsgruppe analysierte Daten aus 13 kontrollierten Studien und kam zu dem Schluss, dass die Proteinurie-Reduktion als hinreichend wahrscheinlicher Surrogatendpunkt für eine wirksame Behandlung gegen das Fortschreiten von IgAN hin zu einer terminalen Niereninsuffizienz herangezogen werden kann.4
Wirksamkeit
Kinpeygo® (16 mg einmal täglich morgens, mind. 1h vor einer Mahlzeit, über 9 Monate) erwies sich bei Patienten mit primärer IgAN sowohl in Bezug auf die primären als auch auf die sekundären Endpunkte der Studie als wirksam.
Primärer Endpunkt
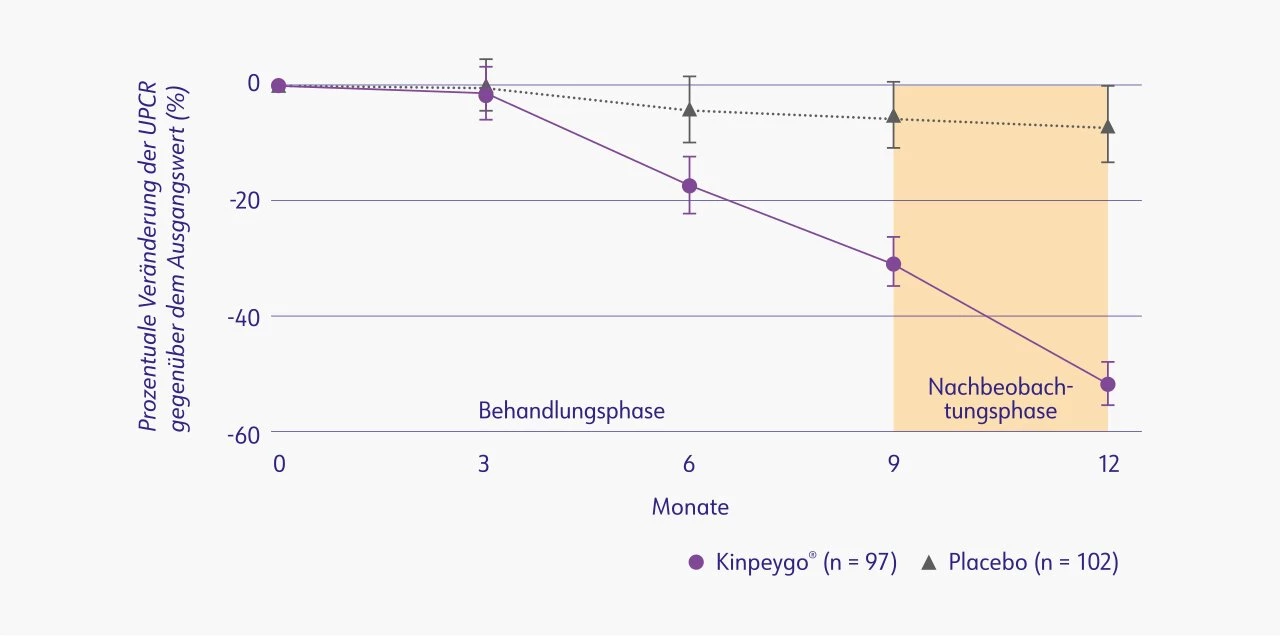
In der Phase-III-Studie zeigte Kinpeygo® (16 mg pro Tag) seine Wirksamkeit am primären Endpunkt (24-Stunden-UPCR nach 9 Monaten im Vergleich zur Baseline). Die durchschnittliche UPCR-Reduktion betrug 31 % in der Patientengruppe mit Kinpeygo® und 5 % in der Placebo-Gruppe.2 Der Behandlungseffekt in Bezug auf die UPCR-Reduktion wurde als prozentuale Veränderung im Vergleich zu Placebo ausgedrückt und war nach 9 Monaten mit 27 % (p=0,0003) statistisch signifikant. Dieser verstärkte sich in der Nachbeobachtungsphase zusätzlich und betrug nach 12 Monaten sogar 48 % im Vergleich zu Placebo (p < 0,0001).2
Prozentuale Veränderung der UPCR (g/Gramm) gegenüber dem Ausgangswert in der Gesamtpopulation2
UPCR: urine protein-to-creatinine ratio (Protein/Kreatinin-Ratio im Urin)
Mod. nach: Barratt et al. (2022).2
Sekundäre Endpunkte
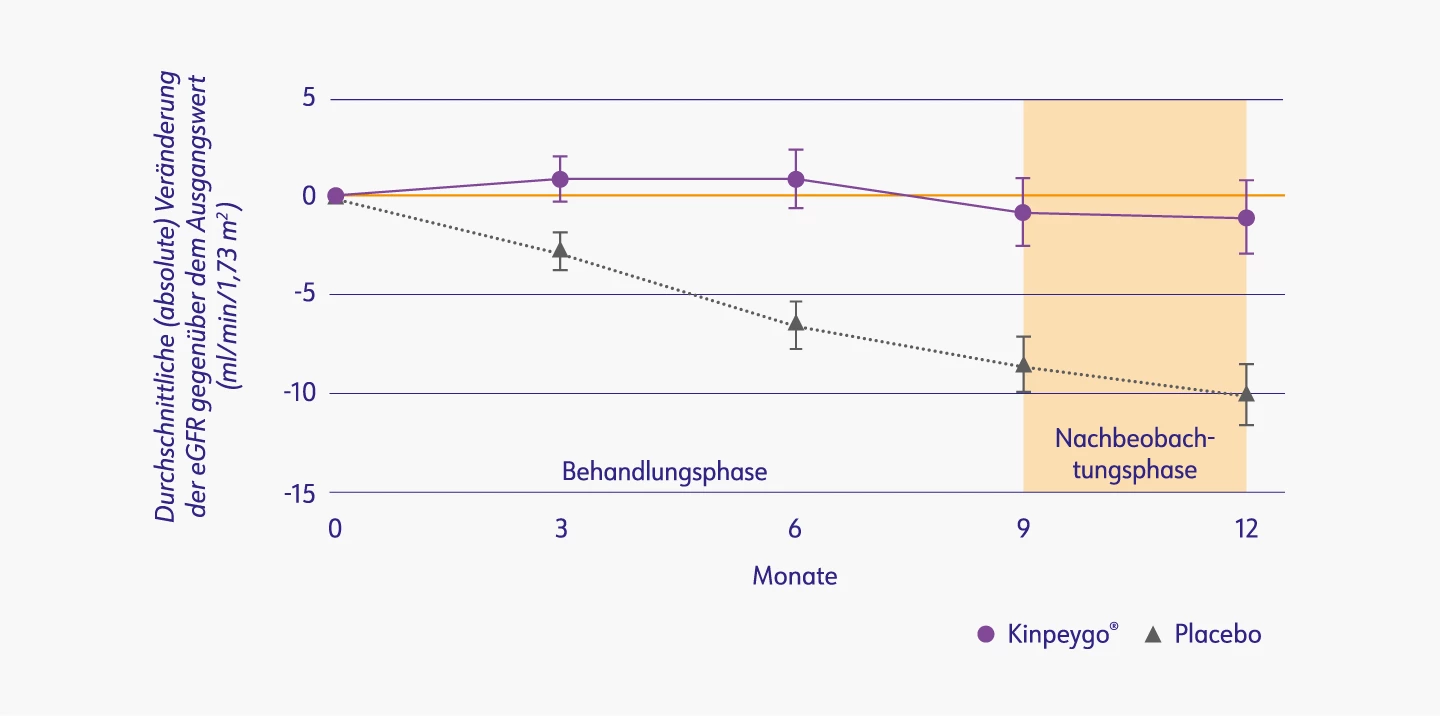
Kinpeygo® überzeugte auch in Hinblick auf die wesentlichen sekundären Endpunkte. In der zulassungsrelevanten Subgruppe, die nur aus Patienten mit ausgeprägter Proteinurie (UPCR ≥ 1,5 g/Gramm) bestand, blieb die eGFR in der Kinpeygo®-Gruppe über 12 Monate nahezu stabil (-1,3 vs. -10,61 ml/min/1,73m2 in der Placebo-Gruppe).2,5
Veränderung der eGFR (ml/min/1,73 m2) gegenüber dem Ausgangswert bei ausgeprägter Proteinurie (UPCR ≥ 1,5 g/Gramm)2
eGFR: estimated glomerular filtration rate (geschätzte glomeruläre Filtrationsrate); UPCR: urine protein-to-creatinine ratio (Protein/Kreatinin-Ratio im Urin)
Mod. nach: Barratt et al. (2022).2
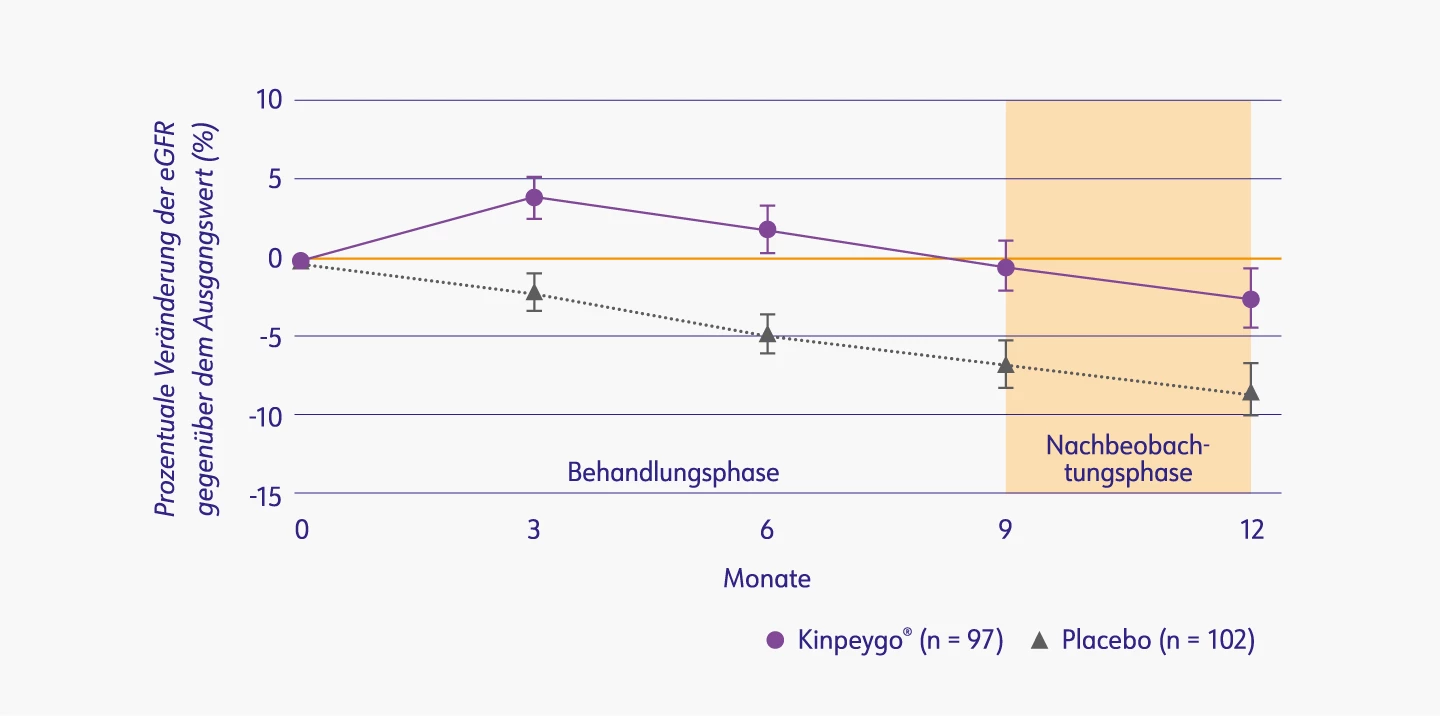
Die Stabilisierung der eGFR zeigte sich ebenfalls in der Gesamtpopulation* und war unter Behandlung mit Kinpeygo® im Vergleich zur alleinigen optimierten RAS-Inhibition nach 9 Monaten statistisch signifikant (p=0,0014). Die Differenz in der eGFR von 7 % entsprach einer absoluten Differenz von -0,17 ml/min/1,73 m² bei Patienten, die mit Kinpeygo® behandelt wurden, und -4,04 ml/min/1,73 m² bei Patienten, die Placebo erhalten haben.2
Prozentuale Veränderung der eGFR (ml/min/1,73 m2) gegenüber dem Ausgangswert in der Gesamtpopulation3,*
eGFR: estimated glomerular filtration rate (geschätzte glomeruläre Filtrationsrate)
* Die Zulassung von Kinpeygo® ist auf Erwachsene mit primärer IgAN und einem Risiko für eine rasche Krankheitsprogression mit einer Protein/Kreatinin-Ratio im Urin (UPCR) von ≥1,5 g/Gramm beschränkt.6
Mod. nach: EPAR Kinpeygo® (2022)3
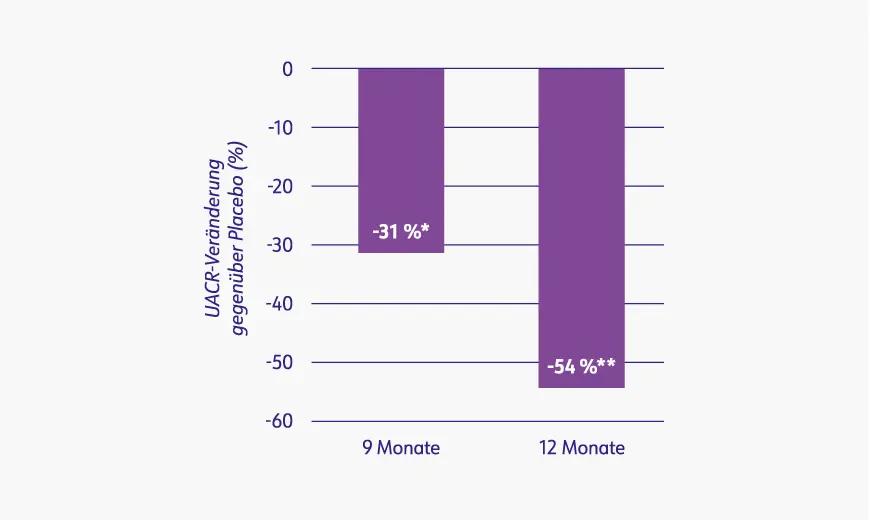
Weitere sekundäre Endpunkte im Rahmen der Phase-III-Studie waren die Veränderung der UACR sowie der Mikrohämaturie.
Reduzierte UACR unter Kinpeygo® vs. Placebo nach 9 und 12 Monaten2
Kinpeygo® bewirkte eine stärkere UACR-Reduktion im Vergleich zu Placebo: Der UACR-Wert verringerte sich nach 9 Monaten um 31 % (p=0,0005) bzw. nach 12 Monaten um 54 % (p<0,0001).2
Reduzierte Mikrohämaturie unter Kinpeygo® nach 9 Monaten im Vergleich zur Baseline3
Unter Behandlung mit Kinpeygo® verringerte sich außerdem der prozentuale Anteil der Patienten mit Mikrohämaturie von 62 % zu Beginn der Studie auf 36 % nach 9 Monaten.3
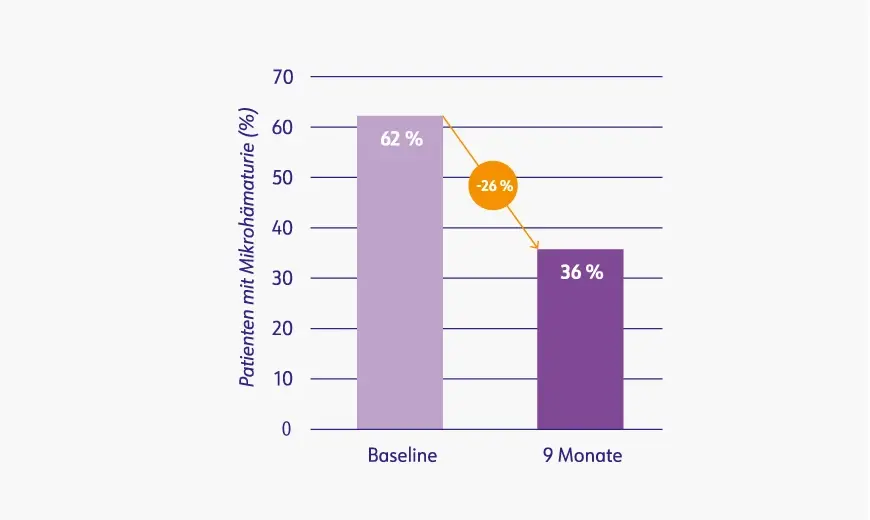
UACR: urine albumin-to-creatinine ratio (Albumin/Kreatinin-Ratio im Urin).
Mod. Nach: EPAR Kinpeygo® (2022).3
Sicherheit
Die 9-monatige Behandlung mit Kinpeygo®, einmal täglich in einer Dosis von 16 mg verabreicht, war im Allgemeinen gut verträglich. Die häufigsten behandlungsbedingten unerwünschten Ereignisse waren mild bis moderat und reversibel, was auf die geringe systemische Exposition von Budesonid nach oraler Verabreichung zurückzuführen ist.2,3
Die 9-monatige Behandlung mit Kinpeygo® war im Allgemeinen gut verträglich2
Patienten mit unerwünschten Ereignissen
TEAE: Treatment-emergent adverse event (behandlungsbedingtes unerwünschtes Ereignis); TESAE: Treatment-emergent serious adverse event (behandlungsbedingtes schwerwiegendes unerwünschtes Ereignis).
Mod. nach: Barratt et al. (2022)2, EPAR Kinpeygo® (2022).3
Ergebnisse zur Sicherheit
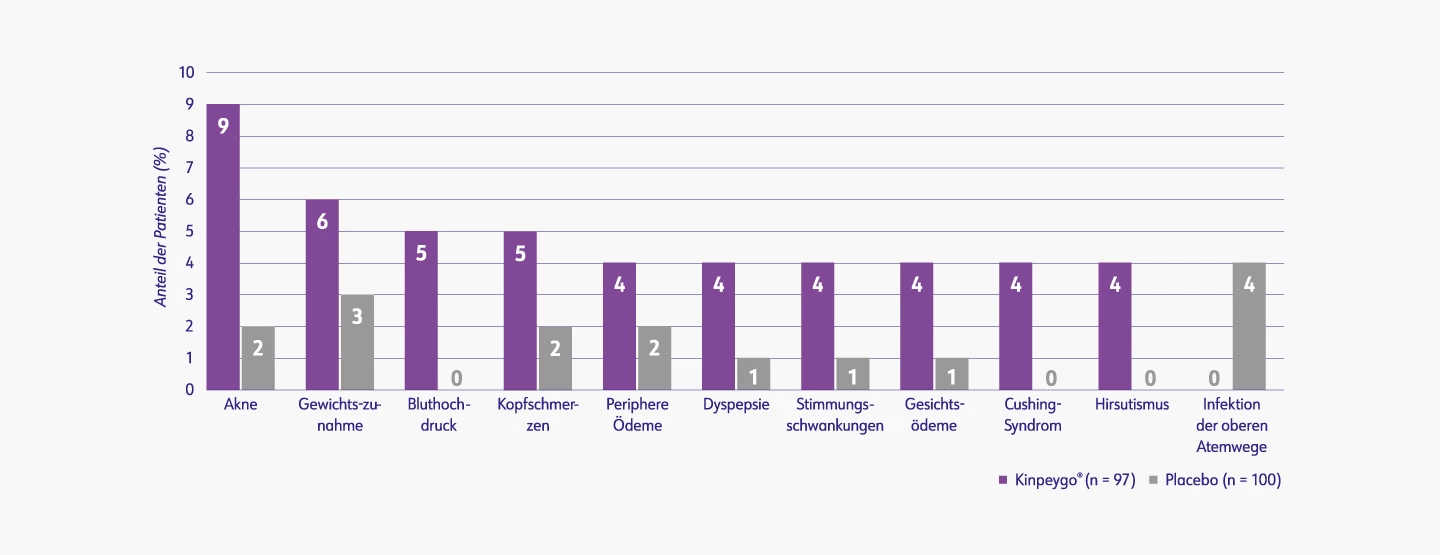
Die behandlungsbedingten TEAEs entsprachen dem zu erwartenden Nebenwirkungsprofil von Budesonid.3
Der Studienmedikation zugerechnete TEAEs* in ≥ 4 % der Behandelten (FAS, n=197)3
FAS: Part A Full Analysis Set (Teil A, vollständiges Analyse-Set); TEAE: Treatment-emergent adverse event (behandlungsbedingtes unerwünschtes Ereignis)* Basierend auf der Beurteilung der Investigatoren, ob ein möglicher kausaler Zusammenhang zwischen dem Ereignis und der Studienmedikation besteht. Falls die Information nicht vorhanden war wurde das Ereignis als behandlungsbedingt gewertet.
Mod. nach: EPAR Kinpeygo® (2022).3
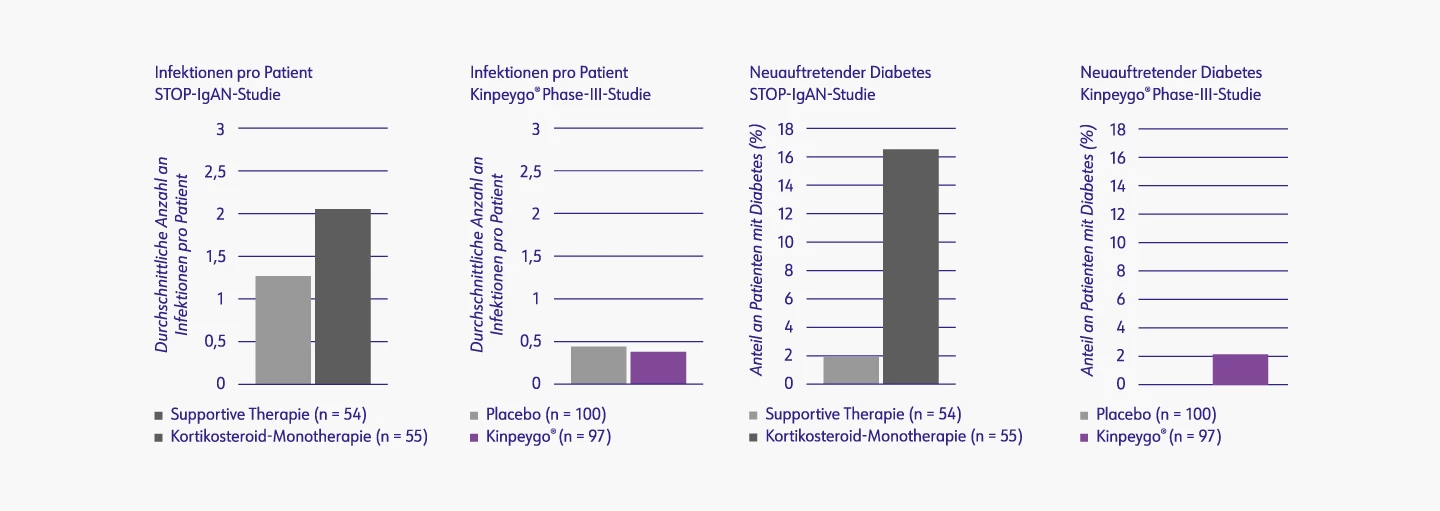
Kinpeygo® im Vergleich zu systemischen Kortikosteroide (STOP-IgAN-Studie)
In der STOP-IgAN-Studie wurden die supportive Standardtherapie und die immunsuppressive Therapie zur Behandlung der progressiven IgA-Nephropathie miteinander verglichen. Generell zeigte sich, dass die Betroffenen von einer zusätzlich zur Standardtherapie durchgeführten Immunsuppression nicht profitierten. Das Gegenteil war der Fall, denn bei Betroffenen, die mit systemischen Kortikosteroiden behandelt wurden, traten häufiger Nebenwirkungen wie schwere Infektionen oder eine gestörte Glukosetoleranz auftraten.7
In der Phase-III-Studie von Kinpeygo® kam es unter Behandlung
- nicht zu vermehrten Infektionen2 und
- nur bei 2 % der Patienten zu neuauftretendem Diabetes, obwohl 45 % zu Studienbeginn prädiabetisch.2
Zwei Patienten entwickelten unter Kinpeygo® einen neuauftretenden Diabetes, bei einem der Patienten haben sich die Werte jedoch bis Monat 12 normalisiert. Beide waren vor Behandlungsbeginn prädiabetisch.2,°
Ausgewählte Nebenwirkungen aus der Kinpeygo® Phase-III-Studie2 und der STOP-IgAN-Studie7,*
* Die Daten stammen aus unterschiedlichen klinischen Studien mit unterschiedlichen Studienpopulationen und erlauben keinen direkten Vergleich.
Mod. nach: Barratt et al. (2022)2, Rauen et al. (2018).7
ACEi: angiotensin-converting enzyme inhibitor (Angiotensinkonversionsenzym-Inhibitor); ARB: angiotensin receptor blocker (Angiotensin-Rezeptor-Blocker); CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; eGFR: estimated glomerular filtration rate (geschätzte glomeruläre Filtrationsrate); EMA: European Medicines Agency (Europäische Arzneimittel-Agentur); IgA1: Immunglobulin A1; IgAN: Immunglobulin-A-Nephropathie; KDIGO: Kidney Disease: Improving Global Outcomes; RAS: Renin-Angiotensin-System; Treatment-emergent adverse event (behandlungsbedingtes unerwünschtes Ereignis); UACR: urine albumin-to-creatinine ratio (Albumin/Kreatinin-Ratio im Urin); UPCR: urine protein-to-creatinine ratio (Protein/Kreatinin-Ratio im Urin).
* Die Zulassung von Kinpeygo® ist auf Erwachsene mit primärer IgAN und einem Risiko für eine rasche Krankheitsprogression mit einer Protein/Kreatinin-Ratio im Urin (UPCR) von ≥1,5 g/Gramm beschränkt.6.
° laut Leitlinie der American Diabetes Association (ADA 2020): HbA1c ≥ 5,7 % oder FBG ≥ 100 mg/dl.
Für mehr Informationen besuchen Sie auch unseren Nephrologie-Bereich: