Schmerzen bei MS
Patienten mit Multipler Sklerose (MS) leiden häufig unter Schmerzen z. B. der Extremitäten, aber auch unter Schmerzen durch Spastiken. In einer Studie nannten über 30 % der Patienten Schmerzen das schlimmste Symptom der Erkrankung.14
Cannabis-basierte Medizin konnte in einer kontrollierten Studie die Schmerzintensität verringern sowie Schlafstörungen verbessern. Darüber hinaus zeigte es allgemein eine gute Verträglichkeit.14
Schimrigk et al. 2017
Dronabinol Is a Safe Long-Term Treatment Option for Neuropathic Pain Patients15
Untersucht wurden die Wirksamkeit und Sicherheit von Dronabinol bei Patienten mit neuropathischen Schmerzen aufgrund von Multipler Sklerose.
| Art der Studie: | RCT (Placebo-kontrollierte Phase-III-Studie mit Open-Label-Extension) |
| Studiendesign: |
|
| Studiendauer: | 16 Wochen verblindet (4 Wochen Titrationsphase) + 32 Wochen unverblindet |
| Studienendpunkte: | Primärer Endpunkt: Veränderung der Schmerzintensität auf einer numerischen 11-Punkte-Skala (NRS) über 16 Wochen Sekundäre Endpunkte: Untersuchung der Sicherheit auf Basis der Nebenwirkungen, Zeichen von Abhängigkeit und Missbrauch |
Ergebnisse
- Keinen signifikanten Unterschied in der Schmerzintensität zwischen den Gruppen während der 16-wöchigen Behandlungsphase (-1,92 vs. -1,81; p = 0,676)
Verträglichkeit
- Generell gute Verträglichkeit
- Höherer Anteil der Patienten mit Nebenwirkungen unter Dronabinol (50,0 % vs. 25,9 %), sank jedoch während Langzeitbehandlung (26 %)
- Keine Anzeichen für Missbrauch, nur ein möglicher Fall von Abhängigkeit festgestellt
- Studie unterstreicht Dronabinol als sichere Langzeitbehandlungsoption
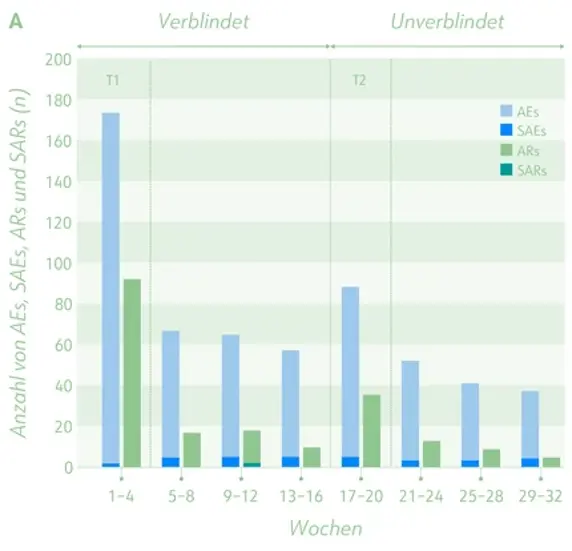
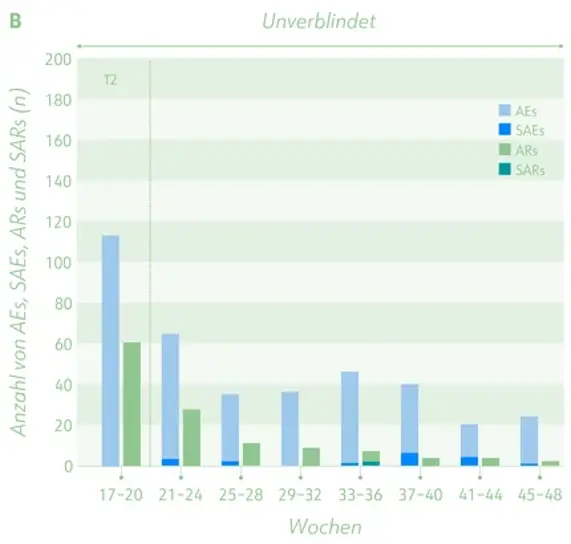
Zeitverlauf des Auftretens von (schwerwiegenden) Nebenwirkungen und (schwerwiegenden) unerwünschten Reaktionen im Dronabinol-Arm (A) und im Arm, der 16 Wochen Placebo und im Anschluss Dronabinol erhielt (B ).
Rog DJ et al. 2005
Randomized, controlled trial of cannabis-based medicine in central pain in multiple sclerosis16
Ein THC:CBD Oromukosalspray wurde in dieser Studie als analgetische Zusatztherapie bei Patienten mit Schmerzen aufgrund von MS mit Placebo verglichen.
| Art der Studie: | RCT (Einzelzentrum, UK, doppelblind, Placebo-kontrolliert) |
| Studiendesign: |
|
| Studiendauer: | 5 Wochen (1 Woche Run-in-Phase + 4 Wochen Behandlung) |
| Studienendpunkt: |
|
Ergebnisse
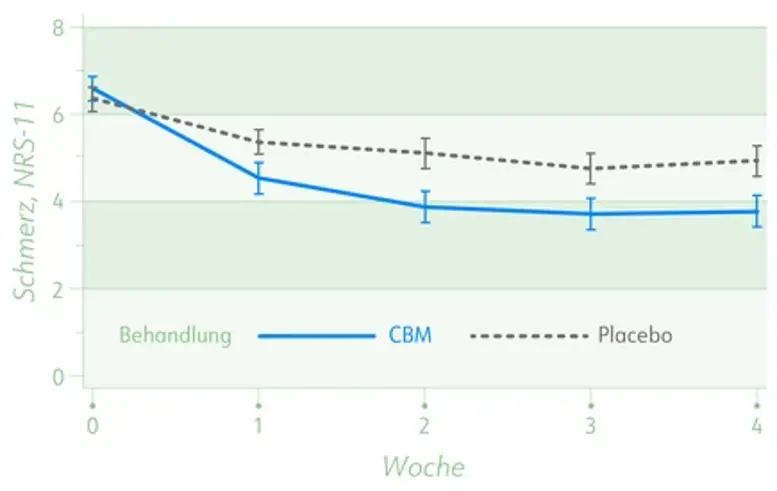
- Signifikante Schmerzreduktion unter THC:CBD im Vergleich zu Placebo (-2,7 vs. -1,4; p = 0,005)
Mittlere Schmerzintensität auf einer numerischen Schmerzskala (0-11, ± SEM) für die Behandlung mit Cannabis-basierter Medizin (CBM) und Placebo.
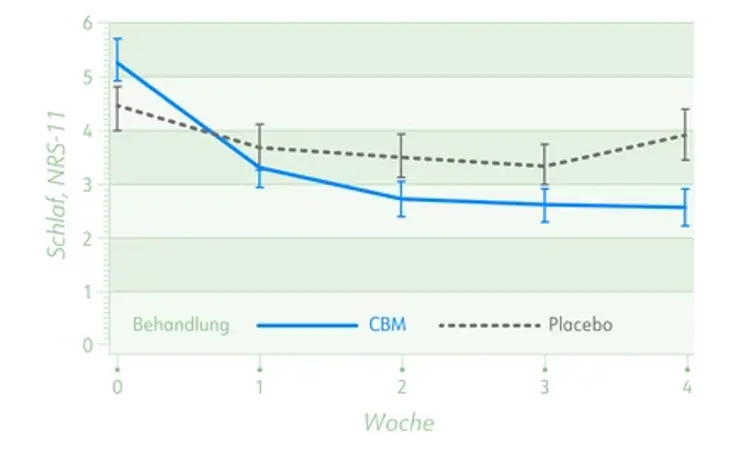
- Signifikante Verbesserung von Schlafstörungen im Vergleich zu Placebo (-2,5 vs. -0,8; p = 0,003)
Mittlere Schlafstörungen auf einer numerischen Bewertungsskala (0-11, ± SEM) für die Behandlung mit Cannabis-basierter Medizin (CBM) und Placebo.
Langford et al. 2013
A double-blind, randomized, placebo-controlled, parallel-group study of THC/CBD oromucosal spray in combination with the existing treatment regimen, in the relief of central neuropathic pain in patients with multiple sclerosis17
Es wurde bei Patienten mit neuropathischen Schmerzen aufgrund von multipler Sklerose, die durch ihre bestehende Behandlung nur unzureichende Schmerzlinderung erfuhren, die Wirksamkeit des THC:CBD-Oromukosalsprays Nabiximols versus Placebo als Add-on-Therapie untersucht.
| Art der Studie: | RCT (doppelblind, Placebo-kontrolliert) |
| Studiendesign: |
Phase A:
Phase B:
|
| Studiendauer: |
Phase A (n = 339):
|
| Studienendpunkte: | Phase A:
|
Ergebnisse
Phase A
- Primärer Endpunkt nicht erreicht
- Anteil der Responder (Schmerzreduktion um ≥ 30 %) vergleichbar in beiden Gruppen (50 % vs. 45 %; p = 0,234) in Phase A
- Aber: Signifikanter Unterschied zugunsten von THC:CBD-Extrakt bei einer Interimsanalyse in Woche 10 (p = 0,046, s. Abb.)
- Keine signifikanten Unterschiede den sekundären Endpunkten in Phase A
Prozent der Patienten mit Verbesserung um 30 % zu Baseline auf NRS (0–10) in Phase A.
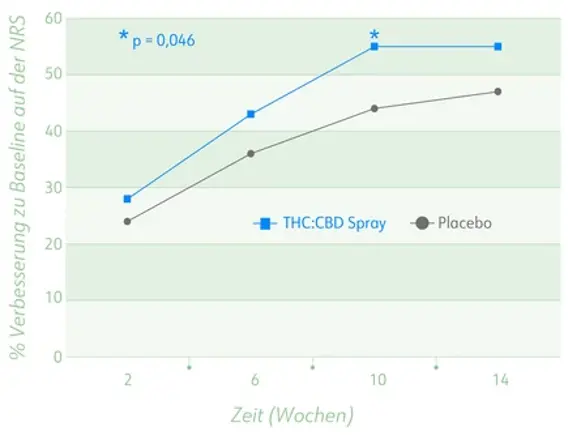
Phase B
- Signifikant geringere Wahrscheinlichkeit des Therapieversagens nach Absetzen in Phase B unter THC:CBD-Extrakt vs. Placebo (24 % vs. 57 %; p = 0,04, s. Abb.)
- Signifikante Verbesserung auf der Schmerzskala (Δ -0,79; p = 0,028) und der Schlafqualität (Δ 0,99; p = 0,015) in Phase B
Wahrscheinlichkeit des Therapieversagens in Phase B.
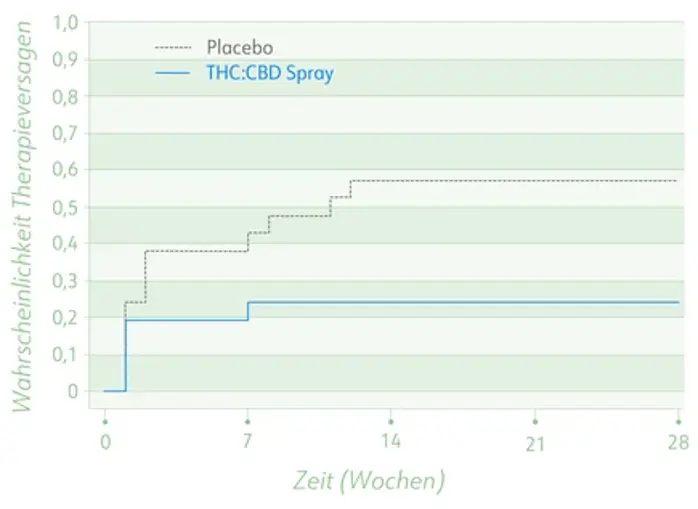
Post-hoc-Analyse zu Phase A
- Patienten mit kürzerer Erkrankungsdauer (≤ 4 Jahre) schienen besser auf die Behandlung mit THC:CBD-Extrakt anzusprechen
Verträglichkeit
- Allgemein gute Verträglichkeit des THC:CBD-Sprays
- Nebenwirkungen waren meist mild bis moderat
Fazit
- Unterschiedliche Ergebnisse in beiden Phasen, weitere Studien zum Potenzial von Cannabis nötig
- Randomisiertes Withdrawal vom THC:CBD-Extrakt führte zu Verschlechterung der meisten Outcome-Parameter, während bei fortgesetzter Therapie der Effekt erhalten wurde. Dieses Ergebnis deutet die Wirksamkeit von THC:CBD-Extrakt in der Langzeit-Anwendung an.